Mesobuthus eupeus zehri kolorektal karsinom sinyal yollarını düzenler ve apoptozu başlatır
- Özgün Sipahioğlu
- 15 Nis 2025
- 23 dakikada okunur
ORİJİNAL KAĞIT
Tıbbi Onkoloji (2025) 42:163
Havva Nur Canak 1 · Kemal Baş1 · Ersen Aydın Yağmur2 · Serdar Karakurt 1
Alındı: 13 Ocak 2025 / Kabul edildi: 13 Mart 2025
© Yazar(lar) 2025
Giriş
Kolorektal kanser (CRC), geleneksel yöntemlerle etkili bir şekilde tedavi edilmesi genellikle zor olan ve olumsuz etkilerle yüklenen önemli bir küresel sağlık sorunudur. Akrep zehirleri, hücre döngüsünü bozma, büyümeyi engelleme ve apoptozu tetikleme yetenekleri göz önüne alındığında, araştırma için benzersiz bir yol sunar. Bu çalışma, Mesobuthus eupeus (M. eupeus) akrep zehrinin kolorektal kanserin moleküler düzeyde çoğalması ve ilerlemesi üzerindeki etkisini araştırmaktadır. Toplam protein
Ayrıca zehirdeki konsantrasyon (607,5 μg/mL) zengin bileşimi ve terapötik uygulamalar için potansiyeli vurguladı.
Çalışma, M. eupeus zehrinin sırasıyla 4,32 ve 7,61 μg/mL'lik IC50 değerleriyle doz bağımlı bir şekilde DLD-1 ve HT-29 kolorektal kanser hücrelerinin çoğalmasını etkili bir şekilde azalttığını ortaya koymaktadır. Zehir ayrıca hücre göçünü engellemekte, koloni oluşumunu azaltmakta ve kanser hücrelerinde apoptozu tetiklemektedir. Zehir ayrıca iki kanser hücre hattında erken ve geç apoptozu indüklemiştir. İnsan kolorektal kanseri ve apoptotik yollar, kolorektal kanserde rol oynayan 16 genin artarken 23'ünün azaldığını ortaya koyan yol panelleri kullanılarak moleküler düzeyde açıklığa kavuşturulmuştur. HT-29 hücre hattında, zehir tedavisinden sonra 57 gen artarken 1 gen azalmıştır. Ayrıca, apoptotik yolda rol oynayan 19 genin mRNA ekspresyonu artarken, DLD-1 hücrelerinde 22 gen azalmıştır. Bu çalışma, M. eupeus'un potansiyelini vurgulamaktadır.
Kanser tedavisinde doğal bir tedavi yaklaşımı olarak eupeus zehri.
Anahtar Kelimeler Kolorektal kanser · Mesobuthus eupeus · Venom · Sitotoksisite · Moleküler mekanizma
Giriş
Kontrolsüz hücre çoğalması, metastaz ve istila ile karakterize edilen kanser, önemli bir küresel sağlık sorunu olarak karşımıza çıkmaktadır [1]. Önde gelen ölüm nedenleri arasında, yalnızca kardiyovasküler hastalıklardan sonra ikinci sırada yer almaktadır [2, 3]. Yaygın bir kötü huylu tümör olan kolon kanseri, erkeklerde akciğer ve prostat kanserlerinden ve kadınlarda meme kanserinden sonra öne çıkmaktadır [4]. Kolorektal kanser, dünya çapında en yaygın kanserlerden biri olarak kabul edilmektedir. Dünya Kanser Araştırma Fonu'nun 2020 istatistiklerine göre, kolorektal kanser, bildirilen tahmini 1,9 milyon yeni vaka ile küresel olarak üçüncü en yaygın kanserdi [5]. Kolon kanserinin karmaşık ilerlemesi, genetik
değişiklikler, APC gen ifadesinin azalmasıyla tetiklenen erken iyi huylu poliplerden KRAS, SMAD4 ve TP53 gibi anahtar genlerdeki mutasyonlar tarafından yönlendirilen agresif kötü huylu tümörlerin oluşumuna kadar değişir [6]. Cerrahi, radyoterapi, kemoterapi ve immünoterapi gibi standart tedaviler etkili olsa da, direnç gelişimi ve sağlıklı hücrelere yan hasar gibi zorluklar sunarlar [7]. Kolon kanseri tedavisinde alternatif yöntemler arayışı, yan etkiler, direnç gelişimi ve hastanın refahı üzerindeki etki gibi geleneksel tedavilerin sınırlamalarından kaynaklanmaktadır [8]. Doğal bileşikler ve yeni yaklaşımlar, bu zorlukların ele alınmasında umut vaat ediyor ve gelişmiş etkinlik, azaltılmış
yan etkiler ve daha bütünsel, hasta merkezli bir yaklaşım.
* Serdar Karakurt
Havva Nur Çanak
Kemal Baş
Ersen Aydın Yağmur
1 Fen Fakültesi, Biyokimya Bölümü, Selçuk
Üniversite, Konya, Türkiye
2 Alaşehir Bitki ve Hayvan Üretimi Daire Başkanlığı
Meslek Yüksekokulu, Manisa Celal Bayar Üniversitesi,
Manisa, Türkiye
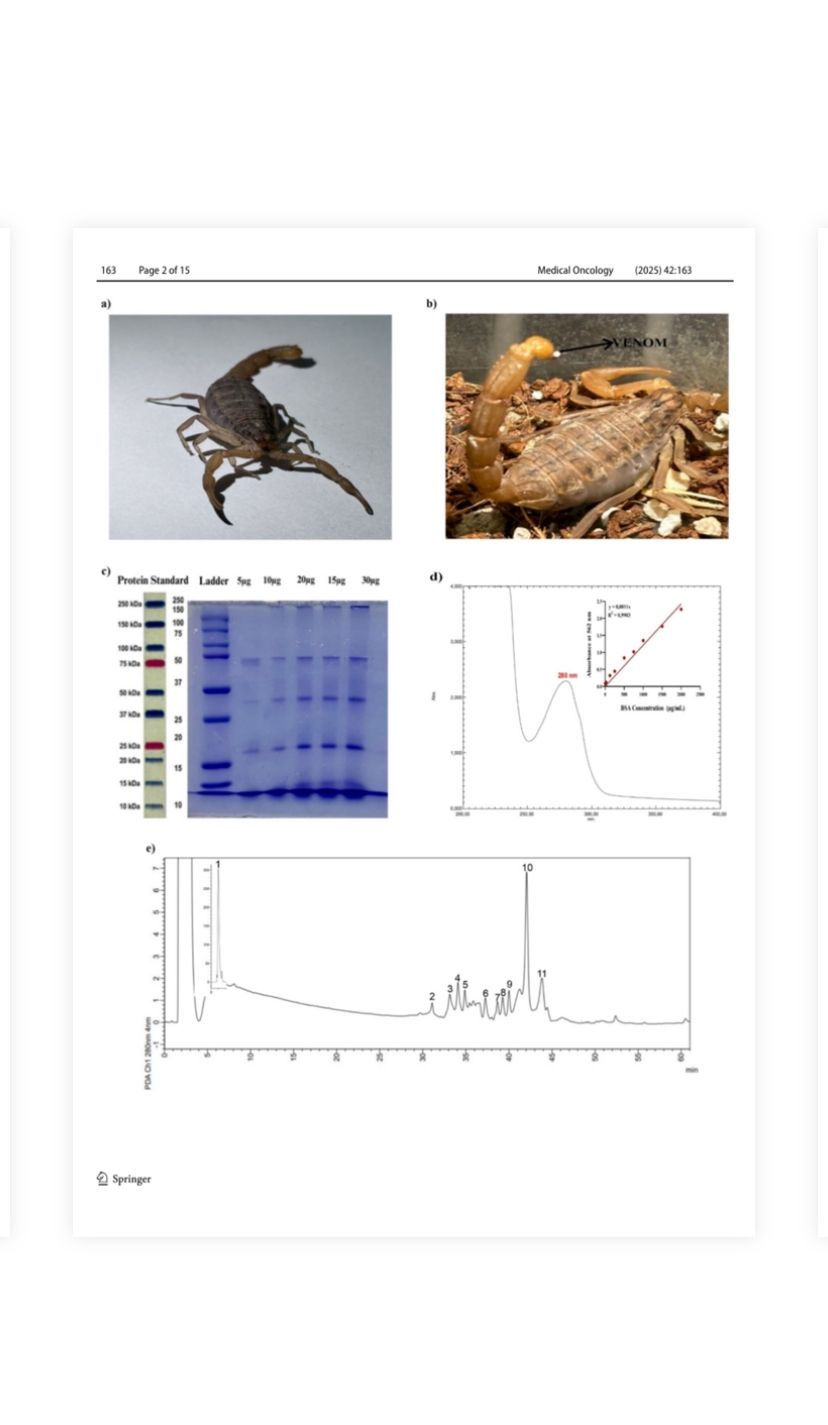
Şekil 1 a M. eupeus türü akrebin görünümü. b M. eupeus'un iğnesinin ucundaki iğne ve zehir. c Zehirlerin elektroforetik profili indirgeyici koşullar altında SDS varlığında poliakrilamid jel üzerinde analiz edildi. Şerit 1: moleküler kütle belirteçleri, Şerit 2–5–30 μg arasında değişen 6 farklı zehir konsantrasyonu. d M. eupeus zehirinin UV-görünür spektrumu ve BCA yöntemi kullanılarak M. eupeus zehirinin protein miktarının analizi.
e M. eupeus zehirinin HPLC ile ayrılması. Akrep zehirinin çözünür kısmı (1 mg protein), ters fazlı bir C-18 kolonu kullanılarak kromatografik ayırmaya tabi tutuldu. Ayırma, çözücü A'nın (dH2O'da %0,1 trifloroasetik asit) çözücü B'ye (asetonitrilde %0,10 TFA) doğrusal bir gradyanı uygulanarak, 60 dakikalık bir süre içinde çözücü B'ye %60 ulaşılarak gerçekleştirildi.
Alternatif yöntemleri benimsemek, tedavi seçeneklerini genişletebilir, sonuçları iyileştirebilir ve kolon kanseri yönetiminde genel bakım kalitesini önceliklendirebilir [9]. Bu nedenle, bitkiler ve hayvan zehirleri gibi doğal kaynaklar gibi alternatif tedavi yollarını keşfetmek önem kazanmaktadır. Yeni tedavi yaklaşımlarını keşfetmek, kanser gibi karmaşık hastalıklarla mücadelede bir özellik haline gelmiştir. Potansiyel tedavi edici ajanların çeşitli kaynakları arasında, akrep zehirleri benzersiz biyoaktif bileşenleri nedeniyle ilgi çekici adaylar olarak ortaya çıkmıştır. Akrep zehirleri,
Güçlü ve seçici peptitler, enzimler ve düşük molekül ağırlıklı moleküller, çeşitli tıbbi uygulamalardaki potansiyel etkinlikleri nedeniyle giderek daha fazla ilgi görmektedir [7].
Akreplerden zehir çıkarmak için maserasyon, manuel ve elektriksel uyarım olmak üzere üç farklı yöntem kullanılmıştır. Maserasyon yöntemi, çıkarma
akrep telsonunun fizyolojik tuzlu su (FTS) ile +4 °C'de 72 saat öğütülmesiyle elde edilen tozun işlemi [10]. Manuel yöntem, akrep zehrinin salgılanması için karın bölgesini uyarır [11]. Elektrik akımıyla sağım yöntemi, zehri istemsiz olarak
canlı akreplerin telson bölgesine 0–50 V'luk bir elektrik kaynağıyla verilen bir elektrik akımıyla akrep zehiri [12]. Evrimin seçici kuvvetleri tarafından şekillendirilen akrep zehirlerinin karmaşık bileşimi, dikkate değer biyolojik özelliklere sahip bir dizi bileşik sunar [13].
Bu ilgi çekici kaynaklar, Suriye, İran ve Türkiye'nin Güneydoğu Anadolu bölgeleri de dahil olmak üzere bölgelerde yaygın olan bir akrep türü olan M. eupeus'un zehri, çeşitli tıbbi uygulamalardaki potansiyel etkinliği nedeniyle dikkat çekmiştir. Kabuk ve mezosoma kırmızımsı kahverengi ve siyah pigmentli
koyu lekeler ve uzunlamasına çizgiler mevcut; metasoma, telson, pedipalpler ve bacaklar kırmızımsı kahverengi, sadece metasomal segment V'in sırt kısmı fuscous; bu akrep türünün metasomal ventral karinaları koyu renklidir [14]. Uzunlukları ortalama 3,9–6,0 cm civarındadır. Pektin organı
dişilerde 18–21 diş ve erkeklerde 21–25 diş [15, 16]. Dişilerde genital operkulum genellikle uzun ve geniş değildir ve III ve IV. bacaklardaki tibial mahmuzlar orta düzeydedir, bu türde III–IV. tergitlerde üç düz ve paralel karina bulunur (Şekil 1a). Bu tür,
Ermenistan, Azerbaycan, Gürcistan, İran (Batı Azerbaycan Eyaleti), Rusya ve Türkiye [14]. Türkiye'de Ağrı, Artvin, Erzurum, Iğdır ve Van illerinden kayıt altına alınmıştır [15]. Bu çalışma, akrep zehrinin insan kolorektal kanserini tedavi etmede potansiyel kullanımını,
hücre canlılığı, metastaz ve koloni oluşumu potansiyeli insan kolorektal kanser hücrelerinde ve sağlıklı kolon epitel hücrelerinde in vitro koşullar altında. Ayrıca hücre ölümü ve kolorektal kanser gelişiminin altında yatan moleküler mekanizmaları açıklamayı amaçlamaktadır.
Sonuçlar ve tartışma
M. eupeus türlerinin akrepleri (Şekil 1a) gece toplandı. Zehir çıkarma işlemi, akreplerin karbondioksit ile anestezi altına alınmasını ve ardından telsonlarının elektriksel olarak uyarılmasını (12 V, 25 amper) içeriyordu (Şekil 1b). Toplanan zehir %0,85 NaCl fizyolojik tuzlu suda seyreltildi, liyofilize edildi ve sonraki deneysel prosedürler için -20 °C'de saklandı. M. eupeus zehirlerinin elektroforetik profili, SDS-PAGE elektroforezi ile analiz edildi [18] ve bu da
zehir bileşiminde 5 ila 50 kDa arasında değişen farklı moleküler ağırlıklara sahip proteinlerin/peptitlerin varlığı (Şekil 1c). Zehrin belirli bir maksimum zirvesi, UV-görünür spektrofotometre ile 280 nm'de gözlemlendi (Şekil 1d). Zehirdeki toplam proteinlerin kantifikasyonu
607,5 μg/mL olarak hesaplandı, bir BCA [17] standart eğrisine (Şekil 1d) atıfta bulunuldu. Daha sonra, bu gözleme dayanarak 280 nm'de HPLC analizi gerçekleştirildi. HPLC analizi, zehir içinde çeşitli fraksiyonlarda ve zaman noktalarında 11 farklı protein/peptidin varlığını ortaya koydu
(Şekil 1e). Kolorektal kanser (CRC), her iki cinsiyet için de oldukça ölümcül bir malignite olarak öne çıkmakta olup, her yıl önemli oranda ölüme yol açmaktadır [17, 18]. Bu kanser türü için geleneksel tedavi yaklaşımlarının etkinliği, sık sık görülen olumsuz etkilerle birlikte yetersiz kalmaktadır. Bu sınırlama, bu yan etkileri hafifletmek ve daha etkili tedavi seçenekleri geliştirmek için alternatif stratejilerin araştırılmasını teşvik etmiştir [19]. Bu yollar arasında, özellikle peptitler ve proteinler gibi çeşitli biyoaktif bileşikler açısından zengin olanlar olmak üzere akrep zehirleri etrafında yoğunlaşan araştırmalar, potansiyel terapötik uygulamaları nedeniyle dikkat çekmiştir [20]. Zehrin toksisitesi bölgeden bölgeye ve hatta aynı tür içinde bile değişebilir [10]. Zehir kaynağı olarak kullanılan telsonların taşınma koşulları gibi faktörler,
Kurutma yöntemi, depolama ve kullanım süresi de zehir toksisitesini etkileyebilir [12]. Oukkache ve arkadaşları tarafından yapılan bir çalışmada [21], akrep zehirlerini toplamak için manuel ve elektriksel uyarım yöntemleriyle elde edilen zehirler üzerinde karakterizasyon ve öldürücü doz (LD50) yürütülmüştür. Manuel olarak çıkarılan zehrin istenmeyen hemolenf türevi maddeler içerdiği ve elektriksel uyarımla elde edilen zehrin, manuel olarak toplanan zehre kıyasla üç kat daha yüksek bir LD50 değerine sahip olduğu bulunmuştur. Karakterizasyon çalışmaları, manuel olarak toplanan zehrin, elektrikle çıkarılan zehrin elektroforetik profilinde bulunmayan ek bir 75 kDa bant içerdiğini ortaya koymuştur. 280 nm'deki emilim profilleri, manuel olarak toplanan zehirlerin elektriksel uyarımla çıkarılan zehirlerde bulunmayan iki ek emilim zirvesine (220-380 ve 520-600 nm) sahip olduğunu göstermiştir. Bu çalışma, karakteristik ve öldürücü doz farklılıklarını göstermiştir
manuel uyarımla ve elektriksel uyarımla çıkarılan zehir arasında, ikincisinin daha doğru sonuçlar sağladığı [21] araştırmalar yürütülmektedir
kanser tedavisinde zehir proteinleri/peptitleri. Zehirlerden izole edilen bazı proteinler veya peptitler, kanser hücre zarına özel olarak bağlanarak kanser hücre göçünü ve çoğalmasını etkiler [22]. Maleki ve meslektaşları, toksik peptitleri izole etmek için karakterizasyon deneyleri yürüttüler
İran akrebi Hemiscorpius lepturus'un zehri, jel filtrasyonu, iyon değişimi ve ters fazlı yüksek performanslı sıvı kromatografisi (RP-HPLC) kullanılarak. Ham zehirden 10 ila 100 kDa arasında moleküler ağırlıklara sahip yedi bant ve 10 kDa'dan daha küçük bir bant tanımladılar.
Ek olarak, RPHPLC'den sonra yüksek saflıkta ve tek bantlı profilleri gösteren HL2153 ve HL2155 olmak üzere iki tepe tespit edildi [23]. Bu çalışmada, M. eupeus'un zehrinden 11 farklı protein/peptit HPLC kullanılarak analiz edildi. Farklılıklar akrep türlerine ve
kullanılan yöntemler. Khoobdel ve diğerleri, M. eupeus zehirindeki proteinleri SDS-PAGE kullanarak analiz etti. %15 poliakrilamid jel kullanarak 5 ila 140 kDa arasında değişen 12 bant tanımladılar [24]. Protein bantlarının 50, 25-37 ve 15-20 kDa arasında olduğu tespit edildi, ancak belirli bir fark bulunamadı
15 kDa'nın altında gözlemlendi. Bu farklılıklar jel yüzdelerinden ve kullanılan belirteçlerden kaynaklanmaktadır.
M. eupeus zehri, hCRC hücreleri, DLD-1 ve HT-29'da hücre canlılığının doz bağımlı inhibisyonunu gösterdi ve hesaplanan IC50 değerleri sırasıyla 4,32 ve 7,61 μg/mL idi (Şekil 2a, b). Ancak, sağlıklı insan kolon epitel hücreleri CCD18-Co üzerinde sitotoksik bir etki gözlenmedi
(IC50 > 250 μg/mL) bu konsantrasyonlarda (Şekil 2a). Gerges ve diğerleri, Smp43 akrep peptidinin IC50 değerini kolorektal kanser hücre hattı (hct-116) için 4,11 μg/mL ve düzenli kolon epitel hücre hattı (FHC) için 62,17 μg/mL olarak belirlediler [25]. Valizade ve diğerleri ayrıca M. eupeus akrebinin
zehir, HT-29 kolon kanseri hücre hattı için 10 μg/mL'lik bir IC50 değerine sahipken, sağlıklı hücre hattı HEK-293 T'yi etkilemedi [26]. M. eupeus zehiriyle tedavi, her iki hücre hattının koloni sayısını kontrol grubuna kıyasla sırasıyla %52,80 ve %63,78 oranında önemli ölçüde azalttı
(Şekil 2c, d). Ayrıca, hCRC hücrelerinin metastaz potansiyeli M. eupeus zehiri tedavisinden sonra (Şekil 2e, g) sırasıyla %89,24 ve %62,28 oranında önemli ölçüde (p < 0,001) arttı (Şekil 2f, h). M. eupeus zehirinin ölüm mekanizmasını açıklamak için apoptotik ve nekrotik oranlar belirlendi
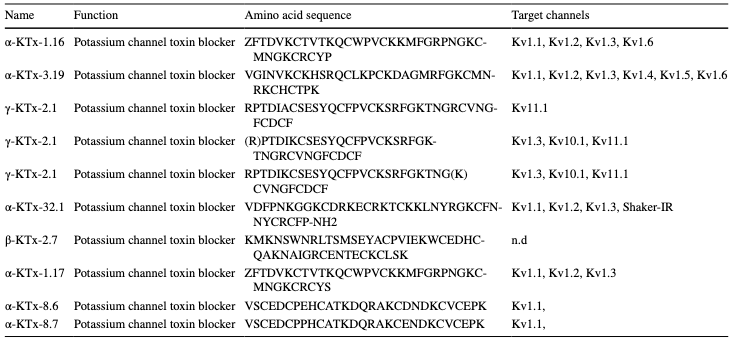
Akış sitometrisi kullanılarak. M. eupeus zehirinin IC50 değerlerinin eşdeğer konsantrasyonu ile tedaviden sonra, erken apoptotik oran DLD-1 ve HT-29 hücrelerinde sırasıyla %21,7 ve %3,18 arttı. Geç apoptotik oran DLD-1 ve HT-29 hücre hatlarında sırasıyla %3,5 ve %10,85 arttı. Nekrotik hücre oranı her iki hücre hattında da kontrol grubuna kıyasla değişmeden kaldı (Şekil 3a, b). Valizade ve arkadaşları, M. eupeus zehirinin HT-29 kolon kanseri hücre hattı üzerindeki etkisini değerlendirmek için MTT analizlerini kullandılar [26]. Apoptotik ve koloni oluşumu analizleri için akış sitometrisi kullanıldı. Sonuçlar, üç μg/mL'nin üzerindeki dozlarda hücre canlılığında önemli bir azalma ile doza bağlı sitotoksisite gösterdi. Ek olarak, akış sitometrisi analizi, zehrin HT-29 hücrelerinde erken apoptoza kıyasla geç apoptozu indüklediğini gösterdi [26]. Bu çalışmada, MTT'den daha spesifik ve hassas olan Alamar Blue yöntemi kullanılarak sitotoksisite çalışmaları yapıldı. Akrep zehri, HT-29 ve DLD-1 kolon kanseri hücre hatlarına karşı önemli sitotoksisite gösterirken, kolon epitel hücre hattı CCD18-Co üzerinde sitotoksik etki gözlenmedi. Apoptozis analizi, HT-29'da daha düşük erken apoptozis oranları ve DLD-1 hücrelerinde erken apoptotik indüksiyonu ortaya koydu. Koloni oluşturma deneyleri, HT-29 ve DLD-1 hücre hatlarında koloni sayılarının ve boyutlarının azaldığını gösterdi. Silico analizler, M. eupeus akrep zehrinde 10 peptit/protein tanımladı (Tablo 1). Bu peptitler potasyum kanal inhibitörleriydi ve M. eupeus akreplerinin hücrelerdeki K+ kanallarını inhibe ederek sitotoksik etki gösterdiğini düşündürmektedir. Ayrıca, Gandomkari ve arkadaşları, M. eupeus zehirinden izole edilen rekombinant MeICT (rMeICT) peptidinin glioma hücreleri üzerinde 3 ve 5 μM'lik IC50 değerleriyle sitotoksik etkisini göstermiş ve in vitro yara iyileştirme deneyleri sırasıyla %58 ve %22'lik yara kapanma yüzdeleri göstermiştir [27]. Bu bulgular, rMeICT peptidinin gliomaları hedef alan bir ajan olarak potansiyelini vurgulamaktadır [26]. Bu çalışmada, in vitro metastaz deneyleri, M. eupeus zehirinin her iki hücre hattında da metastazı engellediğini göstermiştir. Bununla birlikte, daha yüksek yapışkan özelliklere sahip HT-29 hücre hattı, DLD-1'den nispeten daha düşük metastaz oranları sergilemiştir. Metastatik DLD-1 hücrelerindeki farklı moleküler mekanizmalar ve artan protein ifadeleri,
akrep zehri tarafından inhibe edilen, hücre hatları arasındaki göç oranlarını açıklar. M. eupeus zehri ile tedavi, apoptotik yollarda yer alan genlerin mRNA ifadelerini değiştirdi (Şekil S1). Zehir tedavisi 19 genin (ATM, BAG3, BCL2A1, BCL2L11, BIRC5, BNIP3, CASP1, CASP12, CASP3, CIDEB, DAPK2, DFFB, TNF, TNFRSF10A, TNFRSF10B, TNFRSF10C, TNFRSF13, TNFRSF9) mRNA ifadesini artırdı ve 22 genin (BCL2, BCL2L2, BIRC1, BIRC2, BIRC6, BOK, BRCC45) mRNA ifadesini azalttı.
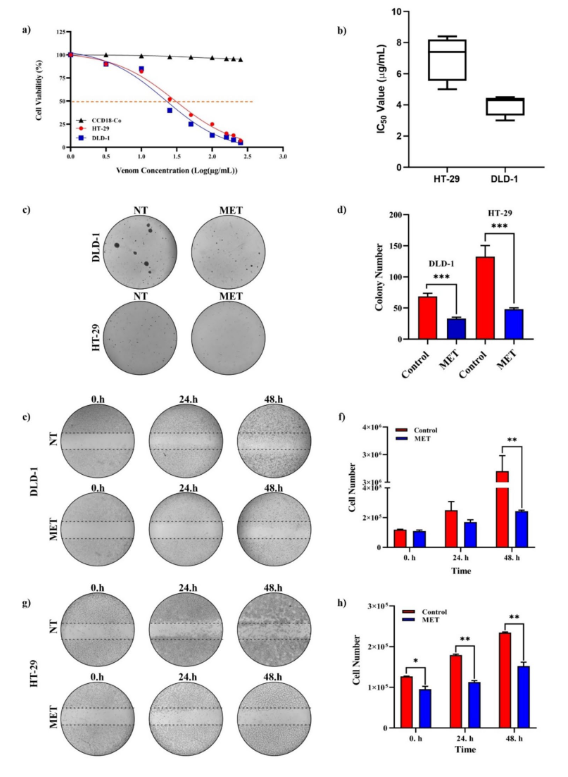
Şekil 2 M. eupeus zehirinin hücre hatları üzerindeki sitotoksisitesi, koloni oluşumu ve yara iyileştirme etkileri. a Akrep zehirinin log konsantrasyonuna karşı hücre canlılığının sigmoidal grafiği. b HT-29 ve DLD-1 hücre hatlarının IC50 değerleri (μg/mL). c DLD-1 ve HT-29 hücre hatlarının koloni görüntüleri. d Koloni
M. eupeus zehirini kontrol grubuyla karşılaştıran sayım. e ve g İn vitro yara görüntüleri
0, 24 ve 48 saatteki iyileşme deneyi. f, h M.'yi karşılaştıran 0, 24 ve 48 saatteki hücre sayısının grafiği.
eupeus zehiri kontrol grubuyla. Sonuçlar üç bağımsız deneyin ortalaması ± SDV olarak sunulmuştur. *p < 0,01, **p < 0,001 ve ***p < 0,0001
DLD-1 hücrelerinde apoptotik yolda CARD4, CASP8, CHEK2, FAS, GADD45A, MCL1, MYD88, RIPK2, RPA3, TNFRSF13B, TNFRSF15, TRAF2, TRAF3, TRIP) (Şekil 4a; Tablo S1). Öte yandan, 12 genin (APAF1, ATM, BAG3, BAG4, BAK1, CASP12, CASP3, CASP5, CASP7, TRAF3, TRAF4, TRIP) mRNA ekspresyonu artarken, 44 genin (BCL2A1, BCLX, BFAR, BIK, BIRC1, CARD4, CASP2, CASP6, CASP8, CASP9, CD40L, CHEK1, CIDEA, CIDEB, CRADD, DAPK1, DAPK2, DFFA, DFFB, FAS, FASLG, GADD45A, HRK, LTBR, MCL1, MYD88, RIPK2, RPA3, TANK, TNFRSF10, TNFRSF10A, TNFRSF10B, TNFRSF10C, TNFRSF11, TNFRSF11B) mRNA ekspresyonu yükselmiştir. TNFRSF13, TNFRSF13B, TNFRSF15, TNFRSF4, TNFRSF8, TNFRSF9, TP53, TRAF1, TRAF5) HT-29 hücrelerinde zehir tedavisinin ardından azaldı
(Şekil 4b; Tablo S1). mRNA çalışmaları, M. eupeus zehir tedavisinin apoptotik yoldaki genlerin ifadesini önemli ölçüde etkilediğini göstermiştir (Şekil 4c, d). DLD-1 hücrelerinde, Bax, Kaspaz-3 ve Kaspaz-12'nin mRNA ifadeleri 3,7 kat, 12,5 kat ve

Şekil 3. DLD-1 ve HT-29 hücre hatlarında M. eupeus zehrinin apoptozis üzerindeki etkileri. a-1 ve b-1 Kontrol grubundaki hücrelerin akış sitometrisi görüntüleri (Tedavi edilmemiş). a-2 ve b-2 M. eupeus zehri ile tedavi edilen hücrelerin akış sitometrisi görüntüleri (Q1: nekrotik hücreler; Q2: geç apoptotik hücreler; Q3: canlı hücreler; Q4: erken apoptotik hücreler). a-3 ve b-3 M. eupeus zehri için kontrol grubuna kıyasla nekroz, erken apoptozis ve geç apoptozis oranı. Sonuçlar üç bağımsız deneyin ortalaması ± SDV olarak sunulmuştur. **p < 0,001 ve ***p < 0,0001
Tablo 1 M. eupeus zehir peptitleri ve olası hedef kanalları
Sırasıyla 1,8 kat (p < 0,0001). Buna karşılık, Bcl-2 mRNA ekspresyonu %68,75 oranında azaldı. HT-29 hücrelerinde, Bax, Kaspaz-3, Kaspaz-9 ve Kaspaz-12'nin mRNA ekspresyonları sırasıyla 3,01 kat, 2,94 kat, 1,78 kat ve 3,8 kat önemli ölçüde arttı (p < 0,0001). Bcl-2 mRNA ekspresyonu, tedavi edilmeyen hücrelere kıyasla %77 oranında azaldı. mRNA ekspresyonlarıyla ilişkili olarak, protein ekspresyonları da M. eupeus zehirinden sonra değişti (Şekil 4e, f). Apoptotik yoldaki anahtar proteinler olan Bax, Bcl-2 ve kaspaz-3'ün protein ekspresyonları analiz edildi (Şekil 4g, 4h). DLD-1 hücrelerinde, zehir tedavisi Bax ve kaspaz-3 protein ifadelerini sırasıyla 1,7 kat ve 1,5 kat artırdı. Öte yandan, zehir tedavisi Bcl-2 protein ifadesini kontrolle karşılaştırıldığında %32 (p < 0,001) oranında azalttı
grup. HT-29 hücrelerinde, zehir tedavisinin ardından Bax protein ifadesinde hiçbir değişiklik tespit edilmedi. Ancak, kaspaz-3 protein ifadesi 1,56 kat artarak önemli ölçüde (p < 0,05) arttı ve Bcl-2 protein ifadesi %50 azaldı (p < 0,0001). M. eupeus zehiriyle tedavi, insan kolorektal kanserinde (hCRC) yer alan genlerin mRNA ifadelerini değiştirdi (Şekil S2). Zehir tedavisi 16 genin (BMP4, CEACAM1, HHAT,
INHBA, ITGA4, PIK3CA, PRKCA, PRKCB, SMAD4, SOX9, STAT3, TYMS, VEGFA, VIM, WIF1, WNT5) ve
DLD-1 hücrelerinde hCRC ilerleme yolunda 23 genin (ALX4, APC, AXIN1, AXIN2, BGN, CDKN2A, CEACAM5, DLL4, DVL2, EGFR, FLT1, FZD1, FZD3, GADD45B, GLI1, IGFBP7, MAPK3, MAPK8, MGMT, MYC, NOTCH2, SFRP2, TGFB2) mRNA ekspresyonunun azaldığı (Şekil 5a; Tablo S2). Öte yandan 57 genin (BMP4, ADAM17, AKT1, ALX4, APC, AXIN1, AXIN2, BGN, BMP1, BMP2, BMP4, BMPR1, BRAF, CDKN2A, CDX2, CEACAM1, CEACAM5, CHRD, DHH, DLL1, DLL4, DVL1, DVL2, EGFR, FAP, FLT1, FZD1, GADD45B, GLI1, HHAT, IGFBP7, ITGA4, JAG1, JAG2, MAPK1, MAPK8, MYBL2, NEUROG1, NGFR, NOTCH1, NOTCH2, PRKCA, PTCH1, PTEN, RASSF2, SLC5A8, SMAD4, SMAD3, SMAD4, SMO, SOX9, TP53, VEGFA) mRNA ekspresyonu VIM, WIF1, WNT1) yükselirken, bir
genin mRNA ifadesi (GLI-2), HT-29 hücrelerinde zehir tedavisinin ardından azaldı (Şekil 5b; Tablo S2). mRNA çalışmaları, M. eupeus zehir tedavisinin APC, KRAS, TP53 dahil olmak üzere hCRC yolundaki önemli genlerin mRNA ifadelerini önemli ölçüde etkilediğini göstermiştir.
PIK3CA, SMAD4, BRAF, PTEN ve CTNNB1 (Şekil 5c; Şekil 5d). DLD-1 hücrelerinde, TP53, PIK3CA, PTEN ve SMAD4'ün mRNA ifadeleri sırasıyla 6,5 kat, 1,37 kat, 1,7 kat ve 4,5 kat önemli ölçüde artarken (p < 0,0001), KRAS mRNA ifadesi %35,29 oranında azaldı. HT-29 hücrelerinde, APC, TP53, SMAD4 ve PTEN'in mRNA ifadeleri sırasıyla 1,86 kat, 2,92 kat, 3,14 kat ve 2,2 kat önemli ölçüde arttı (p < 0,0001). Bcl-2 mRNA ifadesi azaldı
%77 oranında tedavi edilmeyen hücrelere kıyasla. mRNA çalışmalarıyla ilişkili olarak, protein ekspresyon çalışmaları hCRC'de de yükselmiştir (Şekil 5e, f). DLD-1 hücrelerinde, zehir tedavisi p53 proteini, SMAD-4, NF-κB ve PTEN protein ekspresyonlarını sırasıyla 2,6 kat, 3,1 kat, 3,0 kat ve 1,8 kat artırmıştır. Ayrıca, HT-29 hücrelerindeki bu protein ekspresyonları da sırasıyla 3,4 kat, 2,8 kat, 1,2 kat ve 2,6 kat olarak önemli ölçüde (p < 0,0001) yükselmiştir.
Programlanmış hücre ölümü süreci olan apoptoz, normal gelişimde, doku bakımında ve hasarlı hücrelerin ortadan kaldırılmasında önemli bir rol oynar. Apoptoz yolu, dışsal ve içsel yollara ayrılabilir. Ölüm reseptörleri gibi yollarla aracılık edilen dışsal yol
Fas, tümör nekroz faktörü (TNF) reseptörleri ve TNF ile ilişkili apoptoz indükleyen ligand (TRAIL) reseptörleri, harici veya dahili uyaranlar tarafından tetiklenir [28]. Ligandların bağlanması
bu ölüm reseptörleri kaspaz-8'i aktive ederek, cellat kaspazları-3/6/7'yi aktive eder ve apoptozu teşvik eder. Her iki hücre hattında gözlemlenen Fas ve kaspaz-8'deki azalma,
zehrin apoptozis mekanizması üzerindeki etkisi [29]. Hem DLD-1 hem de HT-29 hücre hatlarında kaspaz-3'te artış ve Fas ve kaspaz-8'de azalma gösterildi, bu da zehrin hücre ölümünü dışsal apoptozis yoluyla indüklediğini gösteriyor. Ek olarak, western blot analizi kaspaz-3'teki artışı doğruladı ve zehrin apoptozis üzerindeki etkisini daha da kanıtladı.
RIP (Reseptör Etkileşimli Protein) ve NF-κB hücre sinyalizasyonunda ve bağışıklık tepkisinde kritik öneme sahiptir. RIP hücre ölümü sinyalizasyonunda yer alan bir protein kompleksinin parçasıdır ve aktivasyonu hücre stresi veya hasarı sırasında apoptoza veya inflamatuar bir tepkiye yol açabilir. NF-κB bir transkripsiyon faktörüdür
belirli genlerin ifadesini düzenler. RIP, hücre ölümü gibi hücresel tepkileri düzenleyerek NF-κB sinyal yolunu etkiler [30]. Azalmış RIP gen ifadesi, hem DLD-1 hem de HT-29 hücre hatlarında NF-κB gen ifadesinde artışa yol açtı. Western blot analizi ayrıca şunu gösterdi
her iki hücre hattında da artan NF-κB protein ifadesi, zehrin bu proteinler üzerindeki etkisini gösterir. İçsel apoptoz yolu kemoterapi, radyoterapi ve stres tarafından tetiklenir. İçsel yoldaki pro-apoptotik sinyallemenin işlevsel sonucu mitokondriyal
membranın parçalanması ve sitokrom c'nin sitoplazmaya salınması, apoptotik proteaz aktive edici faktör 1 (APAF1) ve pro-kaspaz-9 ile apoptozomun oluşması. Bu
kompleks başlatıcı kaspaz-9'u aktive eder, bu da daha sonra kaspazlar-3/6/7'yi keser ve aktive eder ve apoptozisle sonuçlanır. Apoptozis paneli sonuçları akrep zehrinin DLD-1 hücre hattında içsel apoptozu etkilemediğini gösterdi. Ancak HT-29 hücre hattında artan APAF1 gen ifadesi ve azalan kaspaz-9 gen ifadesi zehrin kaspaz-3 aracılığıyla içsel apoptozis yoluyla hücre ölümünü indüklediğini düşündürdü. Kolorektal kanser gelişimi kromozomal anormallikleri, gen mutasyonlarını ve proliferasyonu, farklılaşmayı, apoptozu ve anjiyogenezi düzenleyen genlerdeki epigenetik değişiklikleri içerir. Wnt sinyal yolu,
APC ve Axin1/2'yi içeren, hücre çoğalmasında, farklılaşmasında ve apoptozda rol oynar. Wnt'nin aşırı aktivasyonu
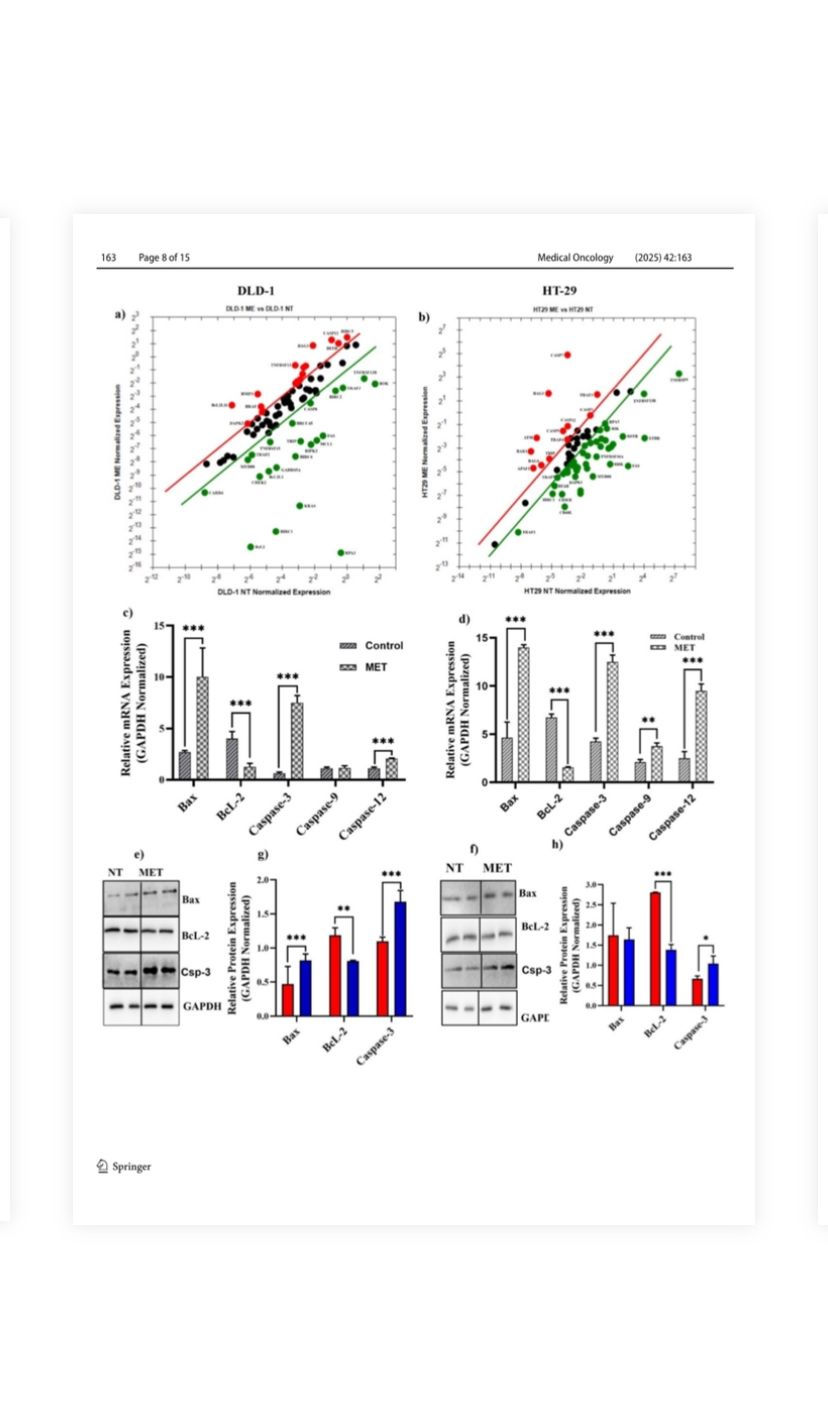
Şekil 4. M. eupeus zehrinin, hastalıkta rol oynayan genler ve proteinler üzerindeki etkileri
apoptozis. a, b 96 genin ifade düzeylerinde değişiklik
M. eupeus akrep zehriyle tedaviyi takiben apoptozis panelinde. c, d BcL-2, Bax,
önemli bir rol oynayan kaspaz-3, kaspaz-9 ve kaspaz-12
apoptozda, DLD-1 ve HT-29 hücre hatlarında kontrol ile karşılaştırıldığında
grup. e, f Bax, BcL-2 ve proteinlerinin Temsili İmmünoblotu
GAPDH. g, h Bax protein ifadesinin bant yoğunluğunun analizi
ve BcL-2 referans grubuna göre kontrol grubuyla karşılaştırıldığında
protein (GAPDH). Sonuçlar üçünün ortalaması ± SDV olarak sunulur
bağımsız deneyler. *p < 0,01, **p < 0,001 ve ***p < 0,0001
yol, kontrolsüz kanser hücresi büyümesine ve tümör oluşumuna yol açabilir [31]. Normalde, Wnt/β-katenin sinyal yolu, APC'nin Axin ile bir kompleks oluşturarak onkogen β-katenin'i parçalamasını, çekirdekteki transkripsiyon faktörlerine bağlanmasını engellemesini ve baskılamasını içerir
c-myc veya siklin D1 gibi genlerin ifadesi. Kolon kanserinde, mutasyona uğramış APC, Axin ile bir kompleks oluşturamaz ve bu da β-kateninin c-myc veya siklin D1'i aktive etmesine izin vererek kontrolsüz hücre büyümesine yol açar. Bu çalışma, DLD-1 hücre hattında APC'nin azaldığını gösterdi ve bu da zehirden hiçbir etki olmadığını gösteriyor,
HT-29 hücre hattında APC ve β-katenin'deki artışlar, zehrin WNT sinyal yolu üzerindeki etkisini gösterirken. Bu çalışma, bu yolların potansiyel katılımını öneren korelatif gen ifadesi verileri sağlarken, doğrudan deneysel doğrulamaya ihtiyaç olduğunu kabul ediyoruz. Wnt/β-katenin yolu kolorektal kanserde iyi belgelenmiştir ve tümör başlangıcında, ilerlemesinde ve metastazında kritik bir rol oynadığı bilinmektedir. Önceki çalışmalar, Wnt/β-katenin yolunun anormal aktivasyonunun hücre çoğalmasını yönlendirebileceğini, farklılaşmayı engelleyebileceğini ve kanser hücresinin hayatta kalmasını destekleyebileceğini göstermiştir [32, 33]. Mevcut çalışmanın gen ifadesi verileri, bu yolun temel bileşenlerinin yukarı düzenlenmesinin bunlarla tutarlı olduğunu göstermektedir
bulgular ve bu yolun M. eupeus zehirinin gözlemlenen etkilerine katkıda bulunabileceğini göstermektedir. Benzer şekilde, NF-κB sinyallemesi inflamasyonun, bağışıklık tepkilerinin, apoptozun ve kanser ilerlemesinin merkezi bir düzenleyicisidir. NF-κB'nin düzensizliği kolorektal kanser patogenezi, kemoterapi direnci ve metastaz ile ilişkilendirilmiştir [34]. Özellikle, çalışmalar NF-κB'nin aktivasyonunun kolorektal kanserde tümör büyümesini ve kemoterapiye direnci teşvik edebileceğini göstermiştir
[35]. Bu çalışmanın gen ifadesi analizi bu gözlemlerle uyumludur ve venomun neden olduğu sitotoksik etkilerde NF-κB sinyallemesinin potansiyel katılımını önermektedir. TP53, DNA hasarına yanıt olarak artan, hücre bölünmesini durduran, apoptozu ve yaşlanmayı başlatan ve bu süreçlerde yer alan genlerin promotör bölgelerine bağlanarak DNA onarımını kolaylaştıran bir tümör baskılayıcı gendir [36]. TP53 gen ifadesindeki artış, venomun DLD-1'de ekstrinsik apoptoz ve HT-29 hücre hatlarında intrinsik ve ekstrinsik apoptoz yoluyla hücre ölümünü başlattığını daha da doğruladı. TGFβ sinyal yolunda, Smad4 kolon kanseri hücrelerinde metastaz ve proliferasyonu desteklemede çok önemlidir [37]. Tümör baskılayıcı Smad proteinleri, TGFβ reseptörlerine bağlandıktan sonra aktive olur ve belirli genlerin ifadesini düzenlemek için çekirdeğe taşınır, böylece metastazı ve kontrolsüz hücre proliferasyonunu engeller [38]. Hem DLD-1 hem de HT-29 hücre hatlarında Smad4 gen ifadesinin arttığı gösterilmiştir. Bu, M. eupeus akrep zehrinin hücre metastazını ve büyümesini engellediğini gösterir. KRAS, yaygın olarak Kirsten Rat Sarcoma Virus adı verilen bir onkogen olarak bilinen bir gen ve protein kompleksidir
Proto-Onkogen. KRAS geni, hücre yüzeyindeki reseptörlere bağlanarak hücre büyümesini ve bölünmesini uyarır. Mutasyona uğradığında, KRAS geni kontrolsüz hücre büyümesine ve bölünmesine yol açabilir ve kanserli tümörlerin gelişimine katkıda bulunabilir [39]. Azalmış bir
DLD-1 ve HT-29 hücre hatlarında KRAS gen ifadesi. Bu, M. eupeus akrep zehrinin hücre büyümesini engellediğini göstermektedir. BRAF geni, hücre içi sinyal iletimini düzenleyen MAPK (Mitogen-Activated Protein Kinase) sinyal yolunda yer alan bir proto-onkogendir. Bu yol, hücresel büyüme, çoğalma, farklılaşma ve hayatta kalma için çok önemlidir. BRAF genindeki mutasyonlar, MAPK sinyal yolunun aşırı aktivasyonuna yol açarak kontrolsüz hücre büyümesi ve bölünmesine neden olabilir [40]. M. eupeus akrep zehri, BRAF genini önemli ölçüde etkilememiştir.
Tümör baskılayıcı bir gen olan PIK3CA, fosfatidilinositol 3-kinazın (PI3K) katalitik alfa alt birimini kodlar. Bu gen, hücre büyümesini, çoğalmasını, farklılaşmasını, hayatta kalmasını ve metabolizmasını düzenleyen PI3K/AKT/mTOR sinyal yolunun önemli bir bileşenidir. Bu yolun aşırı aktivasyonu veya düzensizliği kanser gelişiminde rol oynar [41]. M. eupeus akrep zehri, bu genin DLD-1 hücre hattındaki ifade seviyesini artırdı ancak HT-29 hücre hattını etkilemedi. PTEN, hücre büyümesi, çoğalması, hayatta kalması ve metabolizmasında rol oynayan bir tümör baskılayıcı gen ve protein kompleksidir. PTEN geni, hücre içi sinyal iletimini düzenleyerek hücre büyümesini kontrol eder. PTEN genindeki mutasyonlar veya PTEN proteininin işlevsel kaybı,
kontrolsüz hücre büyümesine ve bölünmesine yol açarak kanserli tümörlerin gelişimine katkıda bulunur [42]. Çalışmalarımız, M. eupeus akrep zehrinin bu geni aktive ettiğini buldu
DLD-1 ve HT-29 hücre hatları, kanser oluşumunu önler. CTNNB1, hücre yapışmasını ve iletişimini düzenleyen beta-katenin proteini ile ilişkilidir. CTNNB1 genindeki mutasyonlar veya beta-katenin proteininin anormal aktivasyonu, hücre büyümesini ve bölünmesini düzenleyen çeşitli sinyal yollarının aşırı aktivasyonuna yol açarak kanser gelişimine ve ilerlemesine katkıda bulunabilir [43]. Bu çalışma, M. eupeus akrep zehrinin DLD-1 hücre hattında bu tümör baskılayıcı geni aktive ettiğini, HT-29 hücre hattında ise herhangi bir değişiklik gözlemlenmediğini gözlemlemiştir. Bir transkripsiyon faktörü olan SOX9 geni, kanser türüne bağlı olarak bir proto-onkogen veya bir tümör baskılayıcı gen olarak hareket edebilir.
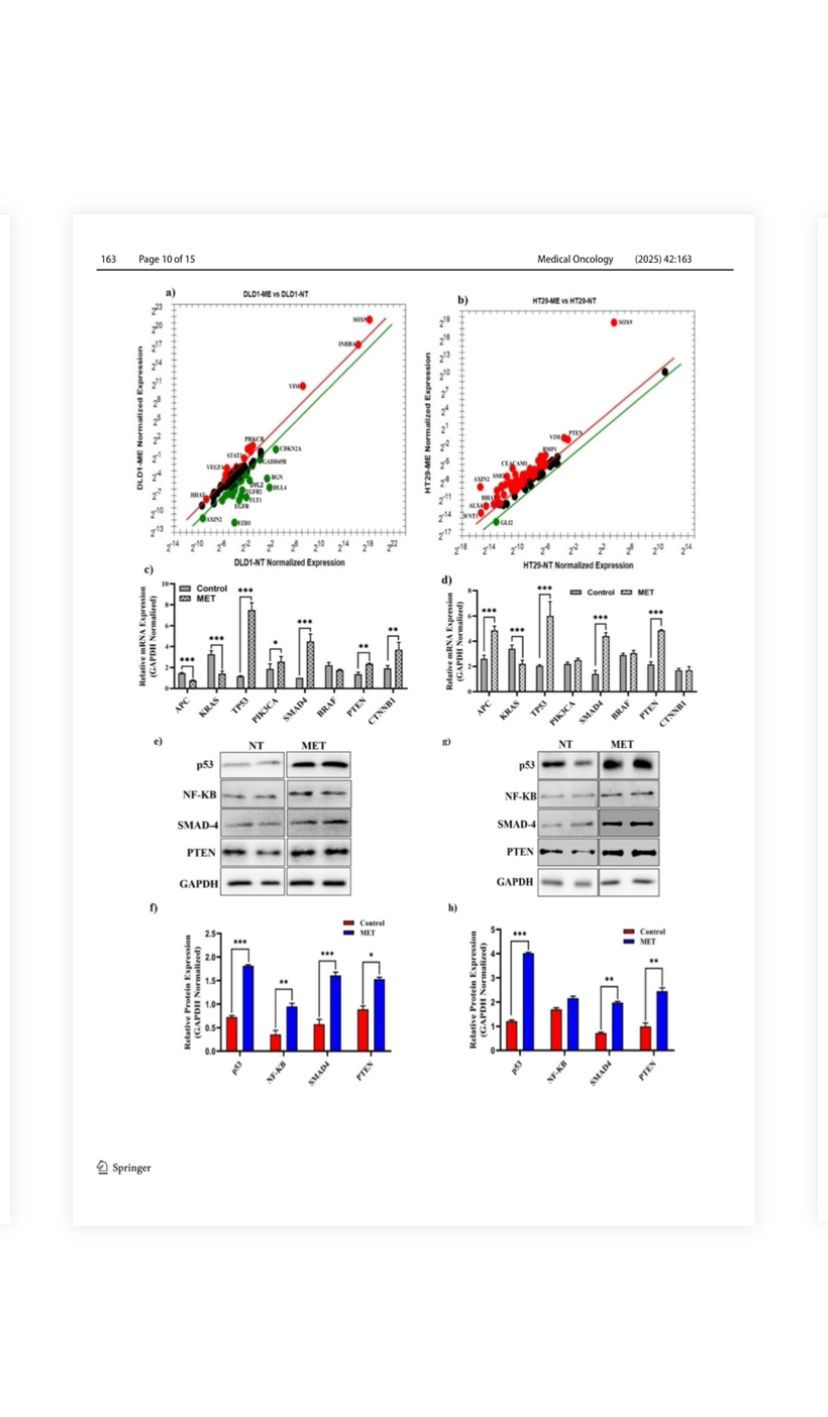
Şekil 5 M. eupeus zehrinin insan kolorektal karsinomu ilerlemesinde rol oynayan genler ve proteinler üzerindeki etkileri. a, b M. eupeus zehrinin tedavisini takiben kolon kanseri gelişiminde rol oynayan 96 genin mRNA ekspresyon düzeylerindeki değişim. c, d DLD-1 ve HT-29 hücre hatlarında kontrol grubuna kıyasla insan kolorektal karsinomu ilerlemesinde rol oynayan NF-κB, TP53, SMAD4, APC, BRAF, KRAS ve MLH-1 genlerinin ekspresyon düzeylerindeki değişim. e, g NF-κB, P53 ve GAPDH proteinlerinin temsili immünoblotu. f, h NF-κB ve P53 protein ekspresyonunun bant yoğunluğunun referans proteine (GAPDH) göre kontrol grubuna göre analizi. Sonuçlar üç bağımsız deneyin ortalaması ± SDV olarak sunulmuştur. *p < 0,01 ve ***p < 0,0001
SOX9 tümör mikroçevresini düzenler, epitel bariyer bütünlüğünü korur ve bağırsak epitelinde doku yenilenmesi için farklılaşmamış kök hücreleri korur. Çalışmalar, kolon kanseri hücrelerinde SOX9'un aşırı ekspresyonunun hücre çoğalmasını engellediğini, SOX9'daki azalmanın ise
ifadesi insan HT-29 kolon kanseri hücrelerinin çoğalmasını artırır [44]. Çalışmalar, SOX9'un hem DLD-1 hem de HT-29 hücre hatlarında artan ifade seviyeleriyle bir tümör baskılayıcı gen olarak hareket ettiğini bulmuştur. Ek olarak, SOX9 Wnt/βcatenin sinyal yolu aracılığıyla hücre göçünü ve invazyonunu etkiler [45]. Kolon kanserinde bir prognostik belirteç olan GLI-2, her iki hücre hattında da azalmış ifade gösterdi [46]. Benzer şekilde, metastatik tümörlerde yüksek seviyelerde ifade edilen bir gen olan VIM, DLD-1 ve HT-29 hücre hatlarında artmış ifade gösterdi [47].
Bir kimyasal maddenin bir ilaç adayına dönüşümü, bileşiğin toksik doğası nedeniyle uzun bir süre alır [48]. Kaptopril, ziconotide, atrakuryum ve eptifibatid, zehir toksinlerinden formüle edilmiş FDA onaylı ilaçlardır [49]. Vejovin ayrıca akrep V. mexicanus smithi'nin zehrinden saflaştırılan bir antimikrobiyal peptittir. Bu peptit ayrıca 100 mM HC 50 ile insan eritrositlerine karşı hemolitik aktivite göstermiştir [50]. Moleküler çalışmalar,
M. eupeus zehrinin insan kolorektal karsinomu ile başa çıkma potansiyeli vardır. Bu nedenle, zehirdeki aktif bileşikler hCRC'ye karşı potansiyelleri açısından daha fazla araştırılabilir.
Sonuçlar Sonuç olarak, M. eupeus akrep zehri kolon kanseri tedavisi için yeni bir terapötik yaklaşım olarak umut verici bir potansiyel göstermektedir ve önemli sitotoksik etkiler göstermektedir.
kanser hücre hatları üzerinde. Çalışmamız, apoptozu indükleme, koloni oluşumunu engelleme ve TGFβ, Wnt ve mTORNF-κB dahil olmak üzere kritik sinyal yollarını düzenleme kapasitesini ortaya koyuyor. Proliferasyon, metastaz ve hücresel davranışı düzenlemedeki çok yönlü rolünü vurguluyor. Zehrin
kanser hücrelerine yönelik seçici sitotoksisite, hedefli bir terapötik ajan olarak potansiyelini vurgulayarak önceki çalışmalarla uyumludur. Umut verici in vitro bulgulara rağmen, bu çalışmanın birkaç sınırlaması vardır, öncelikle karmaşıklığı tam olarak yansıtmayan hücre kültürü modellerine güvenilmesi
in vivo sistemler. Gelecekteki çalışmalar bu sınırlamaları ele almalı ve venomun kesin moleküler mekanizmalarını açıklamalıdır. Özellikle, bileşik izolasyonu ve in vivo modeller, venomun terapötik etkinliğini, güvenliğini ve klinik çeviri potansiyelini değerlendirmek için kritik bir sonraki adımdır.
bu araştırma, zehrin terapötik potansiyelini anlamak için önemli bir adım görevi görmektedir, sonraki aşama aktif bileşenleri izole etmeye, hayvan modellerinde etkilerini doğrulamaya ve güvenlik profillerini değerlendirmeye odaklanmalıdır. Bu çalışmanın ümit verici sonuçları, bu alanda gelecekteki çalışmalar için sağlam bir temel oluşturmaktadır ve M. eupeus zehri, yenilikçi, doğal kanser tedavilerinin geliştirilmesi için ikna edici bir aday olarak ortaya çıkmaktadır. Materyal ve yöntemler Akreplerin toplanması ve zehrin çıkarılması M. eupeus, Iğdır İli'nden gece toplandı
(Melekli Köyü, 5 km kuzeydoğu, 39°57′30′′ K, 44°08′42′′, 865 m, bacak. Yağmur, Sipahioğlu ve Kartal) 16.07.2022'de. Akrepler, içinde hindistancevizi torfu toprağı bulunan 5 L'lik kaplara ve barınak olarak bir yumurta kabına yerleştirildi. Zehir, 12 V/25A elektrik kullanılarak karbondioksit anestezisinden sonra çıkarıldı.
Uyarım. İşlenmiş zehir seyreltildi (%0,85 NaCl), liyofilize edildi ve -20 °C'de saklandı.
Mesobuthus eupeus akrep zehrinin karakterizasyon çalışmaları Zehrin maksimum pikini belirlemek için, 1 mg/mL konsantrasyonda hazırlanan toz M. eupeus zehri, 190 nm ile 400 nm dalga boyu aralığında bir UV-VIS spektrofotometresi kullanılarak analiz edildi. Ham liyofilize zehir (2 mg), 200 μL ultra saf suda çözüldü ve C-18 ters fazlı yüksek performanslı sıvı kromatografisine (HPLC) tabi tutuldu. C-18 kolonu başlangıçta su içindeki %0,1 trifloroasetik asit (TFA) (Eluent A) ve asetonitril içindeki %0,1 TFA (ACN) (Eluent B) ile 1 mL/dakika hızında doğrusal bir gradyan kullanılarak dengeye getirildi. Elde edilen pikler bir PDA dedektörü kullanılarak 280 nm'de izlendi. Zehir konsantrasyonunun ve fraksiyonlarının belirlenmesi Zehirin toplam protein konsantrasyonu bisinkoninik asit (BCA) yöntemi kullanılarak belirlendi ve standart olarak BSA kullanıldı [51]. M. eupeus zehirinin elektroforetik ayrımı sodyum dodeasil sülfat-poliakrilamid jel elektroforezi (SDS-PAGE) kullanılarak gerçekleştirildi
[52]. 5–30 μg liyofilize zehir, indirgeyici olmayan koşullar altında %10 SDS-PAGE jeline yüklendi. 25 mM Tris-glisin, 192 mM glisin ve pH 8,8'de %0,1 SDS içeren bir çalışma tamponunda jele 20 mA sabit akım uygulandı. Daha sonra jel, 30 dakika boyunca %0,2 Coomassie Brilliant Blue R-250 ile boyandı ve 25:12,5:62,5 oranında metanol, asetik asit ve damıtılmış sudan oluşan bir çözücü kullanılarak boyası giderildi. Son olarak, protein bantları bir Syngene Görüntüleme Sistemi kullanılarak görselleştirildi ve yakalandı.
Hücre kültürü koşulları
İnsan kolon kanseri hücre hatları DLD-1 ve HT-29 ve sağlıklı kolon hücre hattı CCD-18Co, bir inkübatörde %5 CO2 ile 37 °C'de RPMI1640, McCoy's 5A Medium ve EMEM'de kültürlendi. Büyüme ortamına hücre büyümesini ve bakımını desteklemek için %10 FBS, %1 penisilin-streptomisin ve iki mM l-glutamin eklendi.
Hücre canlılığı ve sitotoksisite çalışmaları
Akrep zehrinin hücre çoğalması üzerindeki etkisini değerlendirmek için, insan kolon kanseri hücreleri ve sağlıklı epitel hücreleri, kuyu başına 1 × 10 4 hücre yoğunluğunda 96 kuyulu plakalara ekildi. 24 saatlik inkübasyonun ardından, hücreler değişen konsantrasyonlarda (0–250 μg/mL) akrep zehrine maruz bırakıldı ve inkübe edildi. Daha sonra, hücreler daha önce açıklandığı gibi 3 saat boyunca Alamar mavisi reaktifi ile işlendi [53]. Hücre canlılığı verilerinden sigmoidal bir eğri çizildi ve hücre büyümesinin %50'sini engelleyen akrep zehri konsantrasyonu (IC50 ) hesaplandı.
Hücre göçü testi
M. eupeus akrep zehrinin metastatik özellikler üzerindeki etkisini araştırmak için CytoSelect Yara İyileştirme Testi (CellBiolabs, ABD) yürütüldü. Hücreler 6 kuyulu plakalara ekildi, zehrin eşdeğer konsantrasyonu IC50 değeriyle muamele edildi ve 37 °C'de 48 saat inkübe edildi
%5 CO2 ile. Daha sonra hücreler tripsinize edildi ve 24 kuyulu plakalara yerleştirilen eklere aktarıldı. Hücreler, 1 × 10 5 hücre yoğunluğunda ekildi ve 24 saatlik bir inkübasyon süresi boyunca bırakıldı. İnkübasyondan sonra, ekler çıkarıldı ve her iki kontrolün görüntüleri
ve zehirle tedavi edilen gruplar yara kapanana kadar 12 saatlik aralıklarla yakalandı. Göç eden hücrelerin kantifikasyonu Image J yazılımı kullanılarak gerçekleştirildi.
Koloni oluşumu testi
M. eupeus akrep zehrinin kolorektal karsinom hücrelerinin hücresel koloni oluşturma özellikleri üzerindeki etkilerini araştırmak için yumuşak agar koloni oluşumu testi yürütüldü. Hücreler, zehrin IC50 değerinin eşdeğer konsantrasyonu ile muamele edildi ve %5 CO2 ile 37 °C'de 48 saat inkübe edildi. Daha sonra, %10'luk bir dip agar tabakası 6-kuyulu bir plakanın tabanına yayıldı. 5 × 103 hücre %0,7'lik üst agar ile karıştırıldı ve dip agarın üzerine katmanlar halinde yerleştirildi. Jel katılaştıktan sonra, hücrelerin büyüme ortamı plakaya eklendi ve daha sonra 15 gün boyunca %5 CO2 ile 37 °C'de inkübe edildi. İnkübasyondan sonra, hücreler %1 Kristal Viyole ile boyandı ve koloni kantifikasyonu Image J yazılımı kullanılarak ters mikroskop altında gerçekleştirildi.
Apoptozis çalışmaları
Annexin V-APC/ 7-AAD apoptozis kiti (eBioscience, ABD) kullanılarak, M. eupeus zehirinin hücre ölüm mekanizmaları üzerindeki etkileri akış sitometrisi ile belirlendi. Hücreler, zehirin IC50 değerinin eşdeğer konsantrasyonu ile muamele edildi ve 37 °C'de %5 CO2 ile 48 saat inkübe edildi. Daha sonra, hücreler 15.000×g'de 5 dakika santrifüj edildi. Pellet, apoptozis kiti protokolüne (BD Biosciences, San Jose, CA, ABD) göre Annexin V-APC ve 7-AAD antikorları ile boyandı.
Apoptotik ve kolon kanseri ilerleme yollarının mRNA ekspresyon analizi
M. eupeus zehiri tarafından indüklenen apoptotik ve CRC yolaklarının gen ifadelerindeki değişiklikleri açıklamak için kantitatif gerçek zamanlı polimeraz zincir reaksiyonu (qRTPCR) çalışmaları yürütüldü. Hücreler, zehirin IC50 değerinin eşdeğer konsantrasyonu ile muamele edildi ve %5 CO2 ile 37 °C'de 24 saat inkübe edildi. Tedaviden sonra, toplam RNA Trizol yöntemi kullanılarak izole edildi. Elde edilen RNA'nın saflığı ve miktarı NanoDrop™ 2000 (Thermo Scientific) kullanılarak ölçüldü. cDNA sentezlemek için iScript cDNA Sentez Kiti (Bio-Rad, ABD) kullanıldı. İnsan Kolorektal Kanser Paneli ve İnsan Apoptoz Paneli (Şekil S1, Şekil S2), kantitatif gerçek zamanlı PCR (qRT-PCR) kullanılarak apoptotik yol ve CRC ilerleme sinyal yolunun mRNA ifadelerindeki değişikliği araştırmak için kullanıldı. Göreceli mRNA ekspresyonu 2 −ΔΔCt yöntemi kullanılarak hesaplandı. GAPDH, GUSB, PPIA, B2M, HPRT1, PGK1, ACTB ve RPL13A dahili standartlar olarak kullanıldı. Her iki panel de Primer 3 yazılımı kullanılarak tasarlandı ve NCBI blast yazılımı kullanılarak gen özgüllüğü doğrulandı (Tablo S3).
Apoptotik yolun protein ekspresyon analizi
ve kolon kanseri ilerleme proteinleri
Western blot çalışmaları, M. eupeus zehrinin hCRC ve apoptozisle ilişkili protein ifadeleri üzerindeki etkilerini değerlendirmek için yürütüldü. Hücreler, toplam akrep zehri ile tedavi edildi
IC50 değeri ölçülerek 37 °C’de %5 CO2 ile 48 saat inkübe edildi.
SDS-PAGE, lizatı %7,5-12 oranında çözücü jellerde ayırdı
hedef proteinin moleküler ağırlığına göre. Ayrılmış
proteinler bir PVDF membrana transfer edildi. Membran transferinden sonra, bantlar antikor bağlanması için hazırlandı. Bax (21 kDa, 1/1000 seyreltme), Bcl-2 için birincil antikorlar
(26 kDa, 1/1000 seyreltme) MLH-1 (85 kDa, 1/500 seyreltme), p53 (53 kDa, 1/1000 seyreltme), NF-κB (65 kDa, 1/1000 seyreltme) ve GAPDH (36 kDa, 1/2000 seyreltme) 4 °C'de bir gece inkübe edildi. Ertesi gün, membranlar oda sıcaklığında sekonder antikorlarla inkübe edildi
1 saat. Protein bantları bir ECL solüsyonu (BioRad, ABD) kullanılarak görüntülendi ve bir Kemilüminesan Jel Dokümantasyon Sistemi kullanılarak yakalandı. Protein bantlarının yoğunluğu analiz edildi
GeneSys görüntüleme yazılımını kullanarak.
İstatistiksel analiz
Deneysel sonuçların istatistiksel analizleri GraphPad Prism 8.0 yazılımı kullanılarak gerçekleştirildi. İki grup arasındaki karşılaştırmalar Student's t-testi kullanılarak gerçekleştirildi.
Grup içi karşılaştırmalar ANOVA kullanılarak yapıldı. p < 0,05 anlamlılık düzeyi istatistiksel olarak anlamlı kabul edildi. Tüm deneyler bağımsız olarak üç (3) kez tekrarlandı.
Ek Bilgiler Çevrimiçi versiyonda https://doi.org/10.1007/s12032-025-02689-2 adresinden erişilebilen ek materyal bulunmaktadır.
Teşekkürler
Özgün SIPAHIOĞLU'na şükranlarımızı sunmak istiyoruz. ve İbrahim KARTAL'a belirtilen bölgelerdeki akrep toplama çalışmalarına katkılarından dolayı teşekkür ederiz.
Yazar katkıları HNB ve KB deneylerin çoğunu yardım alarak tasarladı, tasarladı ve gerçekleştirdi ve el yazmasını yazdı. EAY veri analizlerine katkıda bulundu. SK el yazmasını gözden geçirdi ve düzenledi. Tüm yazarlar el yazmasının yayınlanmış versiyonunu okumuş ve kabul etmiştir.
Finansman Türkiye Bilimsel ve Teknolojik Araştırma Kurumu (TÜBİTAK) tarafından sağlanan açık erişim finansmanı. Bu çalışma TÜBİTAK (120Z942) ve Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinasyon Birimi (BAP) (Proje Numarası: 22401106) tarafından desteklenmiştir.
Veri kullanılabilirliği Veriler talep üzerine sağlanacaktır. Veri kümeleri yok
Mevcut çalışma sırasında üretilen veya analiz edilen.
Beyanlar
Çıkar çatışması Yazarlar, bu makalede bildirilen çalışmayı etkileyebilecek bilinen hiçbir rekabet eden mali çıkarları veya kişisel ilişkileri olmadığını beyan etmektedir. Yazarlar hiçbir rekabet eden çıkar beyan etmemektedir.
Açık Erişim Bu makale, orijinal yazar(lar)a ve kaynağa uygun atıflarda bulunduğunuz, Creative Commons lisansına bir bağlantı sağladığınız ve değişiklik yapılıp yapılmadığını belirttiğiniz sürece, herhangi bir ortamda veya biçimde kullanım, paylaşım, uyarlama, dağıtım ve çoğaltmaya izin veren Creative Commons Atıf 4.0 Uluslararası Lisansı kapsamında lisanslanmıştır. Bu makaledeki görseller veya diğer üçüncü taraf materyalleri, materyale ait bir atıf satırında aksi belirtilmediği sürece, makalenin Creative Commons lisansına dahildir. Materyal, makalenin Creative Commons lisansına dahil değilse ve amaçladığınız kullanım yasal düzenleme tarafından izin verilmiyorsa veya izin verilen kullanımı aşıyorsa, doğrudan telif hakkı sahibinden izin almanız gerekecektir. Bu lisansın bir kopyasını görüntülemek için http://creativecommons.org/licenses/by/4.0/ adresini ziyaret edin.
Referanslar
1. Piña-Sánchez P, Chavez-González A, Ruiz-Tachiquín M, Vadillo
E, Monroy-García A, Montesinos JJ, Grajales R, Gutiérrez
de la Barrera M, Mayani H. Kanser biyolojisi, epidemiyoloji,
ve 21. yüzyılda tedavi: mevcut durum ve gelecek
Biyomedikal açıdan zorluklar. Kanser Kontrolü.
2021;28:10732748211038736. https://doi.org/10.1177/10732748211038735
2. İşbirlikçiler GMaCoD,. Küresel, bölgesel ve ulusal yaşam
beklenti, her nedene bağlı ölüm oranı ve nedene özgü ölüm oranı
249 ölüm nedeni, 1980–2015: sistematik bir analiz
Küresel Hastalık Yükü Çalışması 2015. Lancet. 2016;388:1459–
3. Da J, Xu M, Wang Y, Li W, Lu M, Wang Z. Kaempferol
hücre çoğalmasını inhibe ederken apoptozu teşvik eder
androjen bağımlı yol ve vaskülojenik baskılama
Prostat kanserinde taklit ve invazyon. Anal Hücre Patolojisi.
2019;2019:1907698.
4. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I,
Jemal A, Bray F. Küresel kanser istatistikleri 2020: GLOBOCAN'ın 185 ülkede 36 kanser için dünya çapında insidans ve ölüm oranı tahminleri. CA: Cancer J Clin. 2021;71:209–49.
5. Ansari B, Aschner M, Hussain Y, Efferth T, Khan H. Naringin tarafından kolorektal karsinogenezisin baskılanması. Fitomedikal. 2022;96: 153897. https://doi.org/10.1016/j.phymed.2021.153897
6. Hasbullah HH, Musa M. Kolorektal kanser tedavisinde p53 ve KRAS'ı hedef alan gen tedavisi: Bir efsane mi yoksa ileriye giden yol mu? Int J Mol Sci. 2021;22:11941.
7. Li Q, Lei X, Zhu J, Zhong Y, Yang J, Wang J, Tan H. Kanser tedavisinde radyoterapi/kemoterapi-immünoterapi:
mekanizmalardan klinik çıkarımlara. Oxid Med Cell Longev.
2023;2023:7530794. https://doi.org/10.1155/2023/7530794
8. Krasteva N, Georgieva M. Nanomalzemelere dayalı kolorektal kanser tedavisi için umut vadeden terapötik stratejiler. İlaçlar. 2022;14:1213. https://doi.org/10.3390/pharmaceutics14
9. Rejhová A, Opattová A, Čumová A, Slíva D, Vodička P. Natural
Kolorektal kanser tedavisinde bileşikler ve kombinasyon tedavisi. Eur J Med Chem. 2018;144:582–94.
10. Özkan O, Adıgüzel S, Ateş C, Bozyiğit I, Filazi A. Optimizasyon
Akrep karşıtı zehir üretimi. J Venom Hayvan Toksinleri Dahil
Trop Dis. 2006;12:390–9.
11. Delori P, Van Rietschoten J, Rochat H. Scorpion zehirleri ve
nörotoksinler: bir immünolojik çalışma. Toxicon. 1981;19:393–407.
12. Özkan Ö. Akrep antivenomu üretimi. Türk Boğa Hijyen Deneyi
Biyolojik 2008;65:97–108.
13. Al-Asmari AK, Kunnathodi F, Al Saadon K, Idris MM. Elementsel
Akrep zehirlerinin analizi. J Venom Res. 2016;7:16.
14. Yağmur EA, Sipahioğlu Ö , Yılmaz Ö, Kılıç MS. Bir anormallik
Mesobuthus turcicus Kovařík ve diğerleri, 2022'de pecten (Scorpiones:
Buthidae). Kommagene J Biol. 2022;6:116–8.




Yorumlar